研究内容
最先端・次世代研究開発支援プログラム(H22-H25)
(LS013)アクチン重合装置の蛍光単分子イメージングによる機械受容細胞シグナルの可視化解明
蛍光単分子バイオイメージングプロジェクト
渡邊 直樹
2002年(2011年追加改訂)
- I:研究の背景
- II:アクチン重合、脱重合経路の謎
- III:アクチンレトログレードフロー:retrograde actin flow
- IV:細胞内シグナル伝達と細胞骨格改編はどこでつながっているか?
- V:プロセッシブアクチン重合をおこなうフォルミンファミリー (new)
- VI:細胞内Gアクチンの動的平衡の役割と定量的シミュレーション (new)
- VII:低分子化合物作用のリアルタイム可視化 (new)
参考: 最近のレビューWatanabe N. Proc. Jpn. Acad. B. Phys. Biol. Sci. 86: 62-83. (2010) リンク1、 リンク2
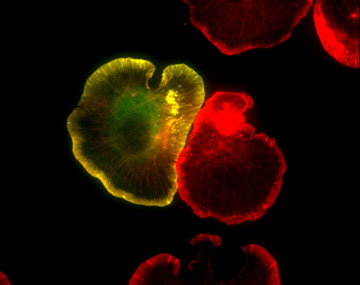
Figure 1: GFP-actin (green) and Texas red phalloidin staining (red) in spreading XTC fibroblasts (fixed). 細胞伸展縁にアクチン線維に富む発達した葉状突起(lamellipodia)が観察される。
I. 研究の背景
ヒトゲノムの全容が解明されたが、生命科学はそれを超える勢いで発展しつつある。細胞内シグナル伝達研究においても多くの分子機構が見出され、遺伝学的、生化学的な解析を通し、分子間相互作用が明らかになりつつある。
しかし、生細胞内におけるシグナル伝達の実態については、多くは詳細が不明なまま単純な図式に表現される。これは現在の生命科学が、遺伝子の同定や関連した生体の最終的な形質変化の捕捉において卓越するものの、中間にある生体内での過程そのものを観る力が十分でないことに起因している。
私はこのような困難を克服するため、生細胞内のアクチン重合、脱重合を可視化、定量化する画像化実験法、単分子スペックル法を開発した(Watanabe N. and Mitchison T. J., Science 295: 1083, 2002)。これは蛍光アクチンの生細胞内1分子イメージングを応用している。これを用い、細胞伸展縁におけるアクチン線維の重合、脱重合のキネティクスを高精度に測定することに成功した。実験結果は、細胞伸展縁のアクチンは細胞辺縁からむしろ離れた起点より盛んに重合していること、約3分の1のアクチン線維が重合後10秒以内に脱重合を開始することを明らかにした(Figure 2, Movie 1, 2参照 )。この細胞内での早いアクチン線維回転にはどんな意味があるのだろう?
私のグループでは、次のような点に注目して細胞運動の原理を探求するとともに、生きた細胞の中で分子のはたらきの直接の検証を可能とするような新しい科学の樹立に挑んでいます。
II. アクチン重合、脱重合経路の謎
細胞はアクチン重合の力によって細胞辺縁を外に押し出す。 また、速い重合を実現するためにアクチンは絶えず脱重合しなければならない。これらはアクチン重合(伸長)を阻害するサイトカラシンや、脱重合を阻害するジャスプラキノライドが1分以内に細胞辺縁の動きを停止させることからも分かる。
しかし、試験管内においてもアクチン重合、脱重合の経路は未だ結論が出ていない部分も多い。特に細胞の伸展部にある葉状突起(厚さ200 ナノメーター弱のベール状の構造)では1000マイクロモーラー以上の高濃度のアクチン分子をはじめ、高密度に細胞骨格制御分子が絡んでおり、このような状況が何を生み出すのか、興味深いところである。
単分子スペックル法を発展させ、アクチンのみならず、アクチンの主要な制御機構にも応用することで、アクチン重合、脱重合の各経路の貢献度を明らかにし、細胞運動の制御シグナルのベールをはぐことを試みている。
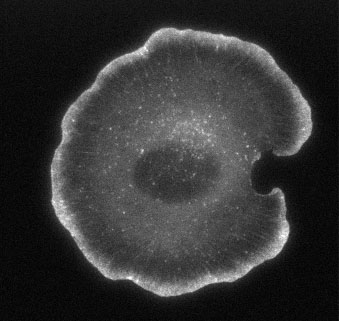
Figure 2. EGFP-actin in a live, spreading XTC cell, and its timelapse movie (Movie1). The expression level of EGFP-actin is hundreds times less than in the cell in Fig. 2. This low density labeling enables visualization of individual molecules bound to cellular structures. Individual fluorescent actin copolymerized with cellular filaments is clearly seen. Time is in minute:second.
Movie 1. EGFP-actin expressed at a high level (conventional GFP-actin movie).Total time, 10 minutes. The centripetal flow of the bulk actin network is observable.
Movie 2. Single-molecule actin speckles in a live XTC cell.The expression level of EGFP-actin is hundreds times less than in the cell in Fig. 2. This low density labeling enables visualization of individual molecules bound to cellular structures. Individual fluorescent actin copolymerized with cellular filaments is clearly seen. Time is in minute:second.
III. アクチンレトログレードフロー:retrograde actin flow
アクチン線維は細胞辺縁において中心に向かって絶えまなく流動していること(retrograde actin flow)が知られている。細胞周辺構造の求心性流動は明視野の顕微鏡観察でも1970年頃より認知されていたが、その意義、制御機構はよく解っていない。細胞辺縁が進展するとき、アクチン線維はその重合によって細胞質膜を前方に押し出す。ところが、アクチン線維は前方への作用とは反対に細胞後方へと流れていくのである。
この求心性流動は部分的にミオシン系の分子に駆動されていると考えられており、細胞外基質がアクチンネットワークへの連結が強まるとアクチン流動が遅くなり、結果先端は前に伸展するモデル(クラッチモデル)が神経細胞の成長円錐を用いた観察などから提唱されている。
蛍光単分子観察でアクチン重合分布と線維の細胞内移動が観察し、細胞内外の変化がアクチン流動といかに連関するかを調べ、アクチン流動と連関するメカニズムを特定し、細胞伸展機構を解明する。
IV. 細胞内シグナル伝達と細胞骨格改編はどこでつながっているか?
生細胞内の分子が細胞構造に結合、解離するダイナミックスを1分子ごとに捉えるイメージング手法、単分子スペックル法をRho のエフェクターであるmDia1のGFP融合蛋白質に応用することを試みている。mDia1はRhoの結合で分子内結合が開裂し(Watanabe N. et al. Nat. Cell Biol. 1999)、他のフォルミン蛋白質の同様にアクチン線維に会合することが予想されるので、Rho-mDia1シグナル伝達をリアルタイムで捉えることができると期待される。
これまでにmDia1がアクチン細胞骨格に会合し、作用を発揮するイメージを捉えることに成功しつつある。Rho-mDia1シグナルの細胞内時空間特異性を地図化し、アクチン線維のどの改編を直接動かしているのかをイメージングを糸口に解明する。
V: プロセッシブアクチン重合をおこなうフォルミンファミリー (new)
フォルミンファミリーは、酵母から哺乳類まで保存されたアクチン重合核形成促進因子であり、多くの生物種で細胞質分裂や細胞の極性形成に重要な働きをもつ。われわれは、フォルミンファミリーが重合するアクチン線維の先端に結合したまま、連続的に線維を伸長させることを蛍光単分子可視化によって明らかにした(Higashida C. et al. Science 2004)。この性質は、長いアクチン線維の迅速な形成を可能にし、実際、細胞内のmDia1は、1秒間に720個ものアクチンモノマーを取り込んで線維を伸長させる。この速度は、モノマーが自由拡散によって付加するときの重合速度限界を大きく上回っており、真核細胞が迅速な形態変化を実現するために獲得した重要なメカニズムではないかと思われる(Movie 3参照)。
また最近、単分子蛍光偏光観察を用いて、mDia1がアクチン線維端をらせん回転しながら、線維を伸長させる様子を可視化することに成功した(Mizuno H. et al. Science 2011)。線維にかかる捻じれを介して、フォルミンファミリーはアクチンの重合・脱重合を振り分けているのかもしれない。
Movie 3. Single-molecule imaging of actin polymerization-driven molecular movement of the mDia1 FH1-FH2 domain mutant, ΔN3. mDia1 directionally moves at ∼2 μm/sec by processively polymerizing an actin filament until being trapped by the actin network or the cell leading edge. Time is in second. Scale bar, 2 μm.
VI: 細胞内Gアクチンの動的平衡の役割と定量的シミュレーション (new)
mDia1を活性化する化合物として、単量体アクチンの阻害剤latrunculin Bが意外にも見いだされた。薬物動態シミュレーションによって、latrunculinは、アクチン重合の複雑な代謝回路において、重合可能な遊離アクチンを逆説的に増加させることが判明した。このlatrunculinパラドックスは、薬剤処理によって薬剤フリーの標的が増加する前例をみないケースである。重要なことに、アクチン脱重合が高い細胞内部位に一致して、mDia1が盛んにアクチン重合核をつくりだす様子が観察された(Higashida, C. et al., J. Cell Sci. 2008)。低分子量化合物によるシステムの搖動と定量的モデル化を、分子可視化によるリアルタイム観察と組み合わせることによって、複雑な生命システムのホメオスターシスや動的平衡が理解された例である。
VII: 低分子化合物作用のリアルタイム可視化 (new)
われわれは、単分子可視化手法を分子標的薬の作用機構解明にも応用している。われわれの報告(Fujita A. et al. Mol. Pharmacol. 2009)も含めた最近の研究から、阻害薬がATP結合ポケットへ結合することにより、キナーゼがコンフォメーションを変化させる例がいくつか知られるようになった。これらの知見は、新規抗がん剤などの創薬のための新たな戦略を生み出す鍵となるかもしれない。